应同写意邀请,恒诺康医药董事长张健存在“2022新型生物药先进技术峰会”上做了《mRNA疫苗和药物共转录加帽技术研究进展》的报告,本文系根据报告内容整理。
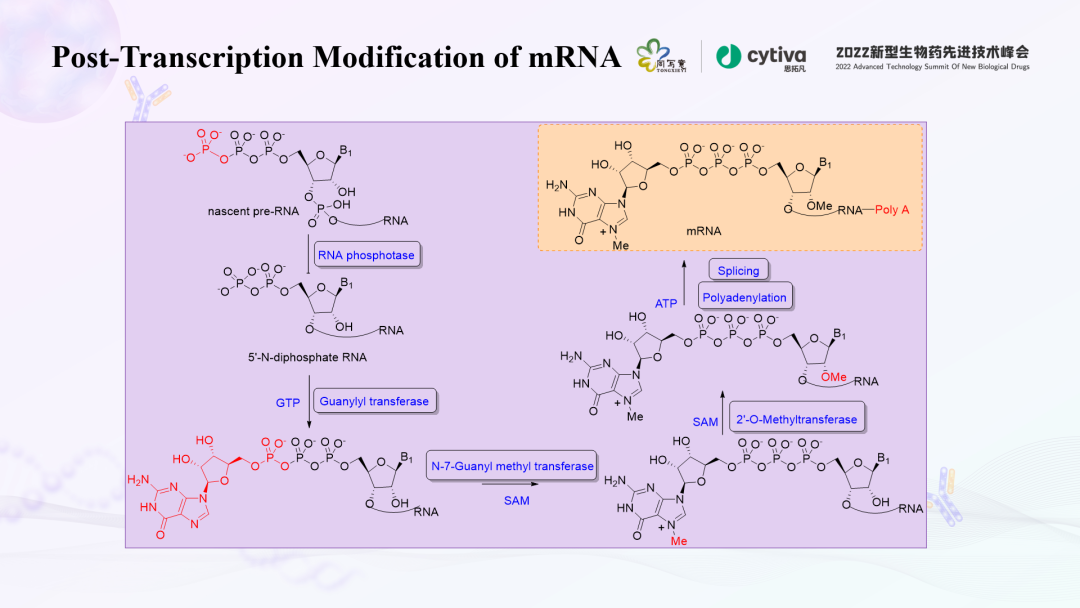
众所周知,分子生物学的核心理论,是从DNA到RNA、蛋白。而转录,就是从DNA生成RNA的过程。但是,在细胞核内以DNA模板生成的是premature的RNA,需要在细胞核内进行一系列后转录的修饰,生成成熟的mRNA,转移到细胞质内进行后续的翻译过程,形成相应的蛋白。后转录修饰是非常复杂的过程,包括几种酶的应用。下图大体描述了这一过程的变化。
mRNA疫苗和药物因为具备安全性高、免疫性好、开发周期短以及量产迅速等优势,已经逐步应用到传染病疫苗、肿瘤细胞治疗、罕见病治疗、蛋白代替疗法等领域。
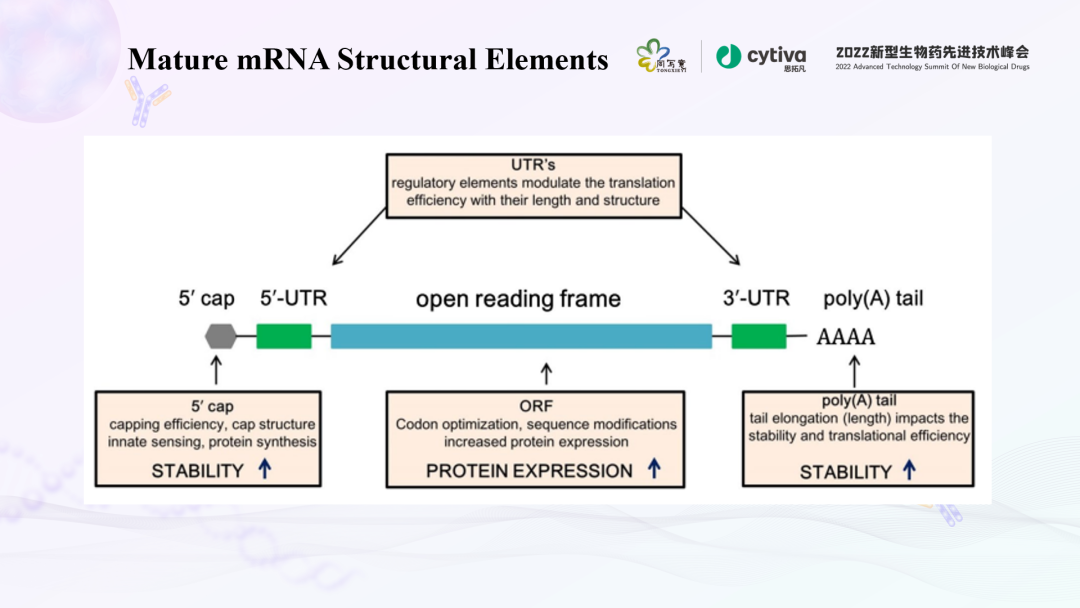
在真核细胞中,成熟的mRNA具备一些关键的结构元件来发挥相关的功能。而体外转录的mRNA,则是通过模拟内源性mRNA的结构来发挥作用。成熟mRNA的结构主要有五个部分,从5' 到3' 包括:5' 帽子结构(5' cap)、5' 非翻译区(5' UTR)、编码抗原的开放阅读框、3' 非翻译区(3' UTR)和一个PolyA尾。
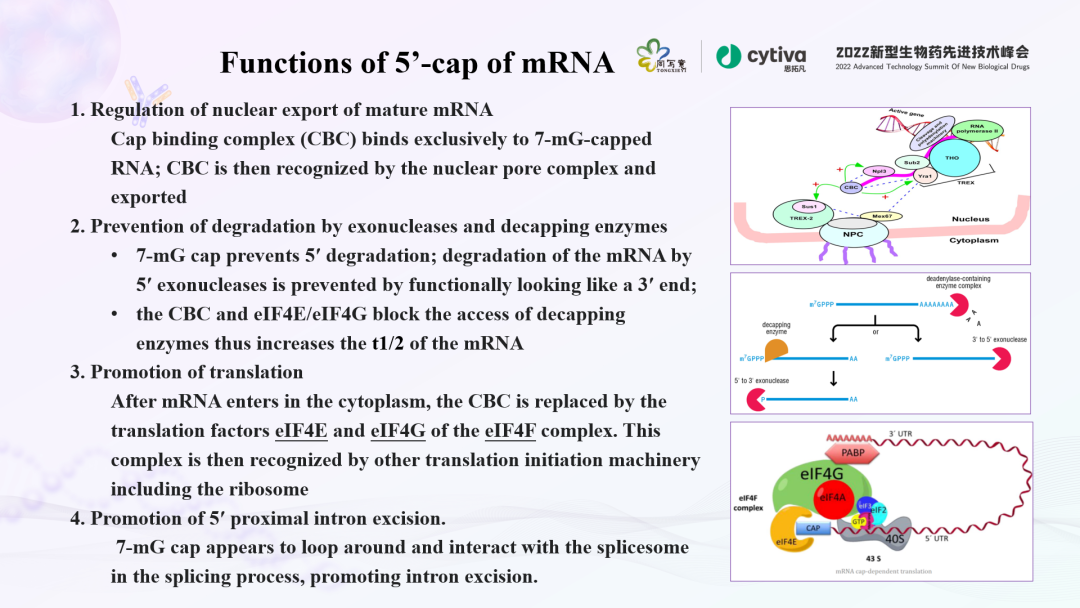
新冠mRNA疫苗快速研发、生产和批准,使世界对mRNA有了更深入的认识。当前有很多研究正在开展,不仅是疫苗、药物应用上,也涉及各种细胞治疗、基因治疗方面,验证着mRNA的潜力。而想要实现这些突破,帽子结构(cap)对于mRNA来说至关重要。5' 帽子结构包含一个7-甲基鸟苷核苷。现有研究发现,5' 端帽子结构可以调节mRNA的剪切成熟,并帮助RNA转录产物穿过核膜的选择性孔道而进入细胞质。此外,5' 帽子结构还可以保护mRNA不被核酸外切酶降解,与翻译起始因子蛋白协同工作,招募核糖体,并协助核糖体与mRNA结合,使翻译从AUG开始。
抗原编码区两侧的5' UTR、3' UTR和PolyA尾的长度,则可以调节mRNA翻译和半衰期。mRNA疫苗和药物的开放阅读框,是实现功能的关键组成部分。这部分通过密码子优化,在不改变蛋白质序列的情况下增加翻译。在转录过程中,该部分加入假尿苷、N1-甲基假尿苷或其他核苷类似物,这些修饰核苷酸的引入阻止了模式识别受体的识别,确保翻译过程产生足够的蛋白质。分别来自Moderna和Pfizer/BioNTech的两款新冠mRNA疫苗,都含有前述的核苷修饰。
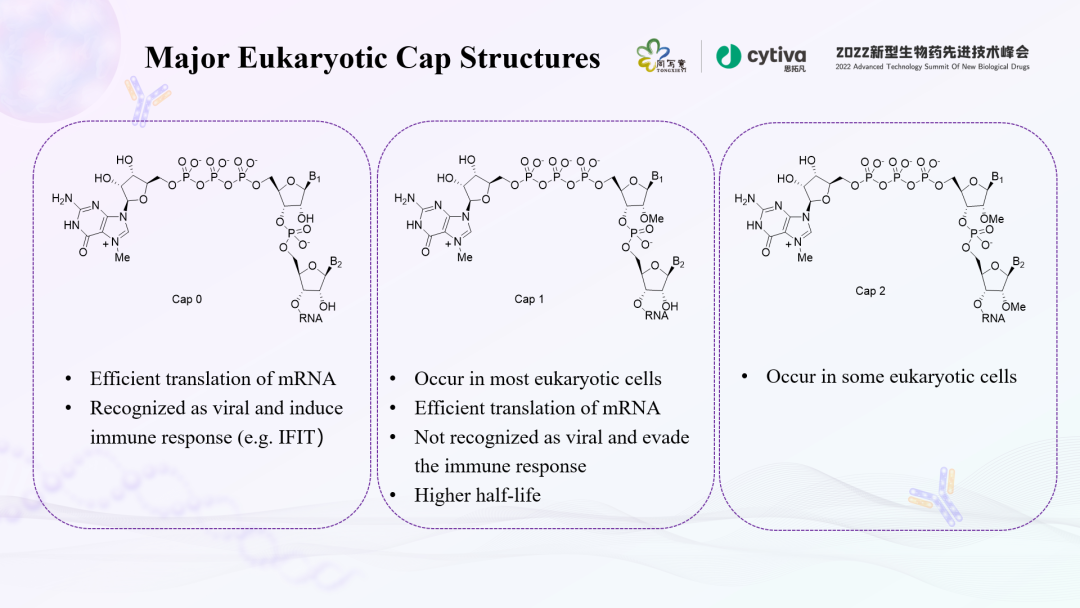
帽子结构是指在真核生物中转录后修饰形成的成熟mRNA在5'端的一个特殊结构,即m7GPPPN结构,又称为甲基鸟苷帽子。它是在RNA三磷酸酶、mRNA鸟苷酰转移酶、mRNA(鸟嘌呤-7)甲基转移酶和mRNA(核苷-2' )甲基转移酶催化形成的。根据甲基化程度不同,在自然界的mRNA可形成3种类型的帽子:Cap 0、Cap 1和Cap 2。
鸟苷以5'-5' 焦磷酸键与初级转录本的5' 端相连。当G第7位碳原子被甲基化形成m7GPPPN时,此时的帽子称为“Cap 0”,它存在于单细胞中。如果转录本的第一个核苷酸的2'-O位也甲基化,形成m7GPPPNm,称为“Cap 1”,除了单细胞生物外,这是一种多数的帽子形式。换言之,Cap 0和Cap 1的主要区别,在于第一个核苷酸的2'-O位羟基是否被甲基化。甲基化具有非常重要的活性和功能,可以提高mRNA在体内表达量,同时帮助mRNA逃脱体内免疫系统识别,更好地稳定mRNA结构。如果转录本的第一、二个核苷酸的2'-O位均甲基化,成为m7G-PPPNmNm,则称为“Cap2”。10%-15%真核细胞中存在Cap 2,但它的作⽤在很⼤程度上尚未得到探索。真核生物帽子结构的复杂程度与生物进化程度关系密切。而mRNA想要成为一种大规模的商业化产品,体外转录环节尤其关键。mRNA疫苗或者药物需要形成Cap 1结构,才能在体内稳定表达。
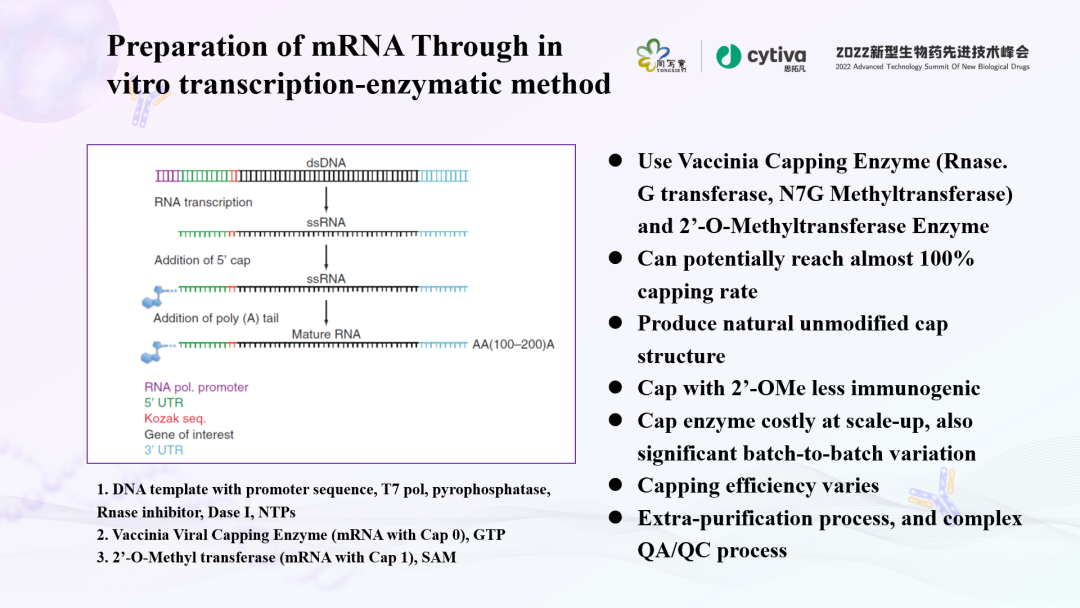
在体外转录、制备mRNA有不同的方法,包括酶加帽、共转录加帽等。
这种方法最为传统,通过dsDNA作为底物,经过转录形成RNA,再经后续修饰成为mature的RNA。
这方面有一个发现值得关注。利用牛痘病毒加帽酶(VCE, Vaccinia caping enzyme)和二氧甲基转移酶(2'O-methyltransferase),可以实现天然未修饰的帽结构。这种方法几乎可以达到100%的加帽率,问题在于,牛痘病毒加帽酶比较昂贵,需要的酶促成本高(T7聚合酶、无机焦磷酸酶、DNA酶I),批量生产成本高。另外,引入了额外的蛋白和S-腺苷甲硫氨酸(SAM),工艺流程繁琐,需多次纯化,增加了QA/QC检测项。
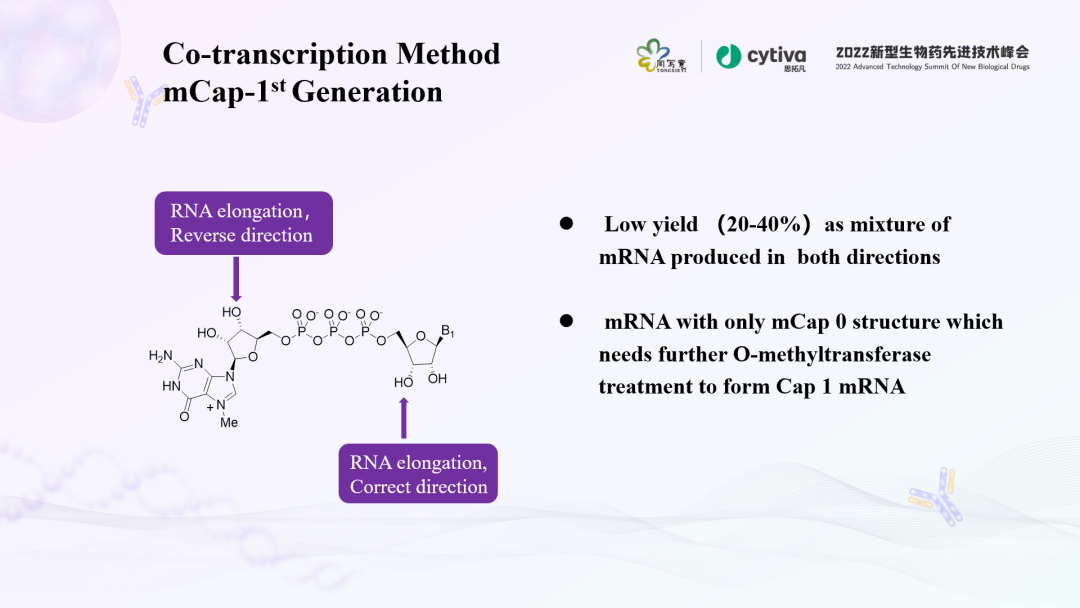
利用帽类似物直接进行体外转录生成带帽结构的mRNA,工艺流程简便,迅速提升mRNA疫苗和药物的产能。基于化学合成工艺的发展,帽类似物的结构已经从最开始第一代的mCap逐步发展到第二代的ARCA和第三代Cap 1类似物(CleanCap)。第一代帽类似物mCap,标准帽结构类似物由于存在两个游离的3'-OH部分,m7Gppp G能够以两种方向整合m7G(5' )pppG-RNA或G(5‘)pppm7G-RNA,产生转录本为5' -加帽和5' -三磷酸的混合转录产物。
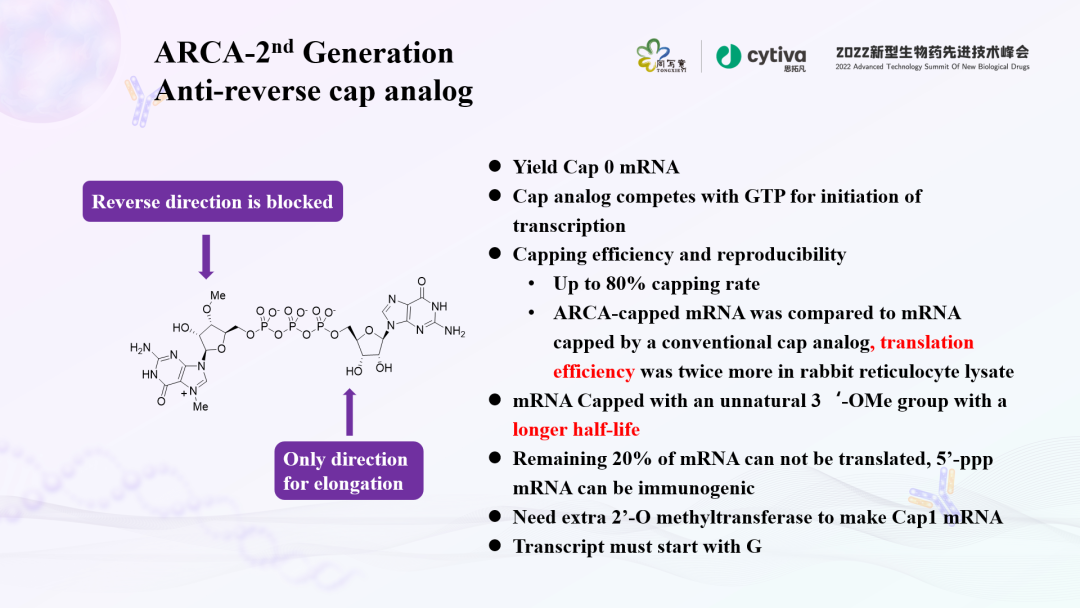
帽类似物以错误的方向掺入形成的反向帽结构与eIF4E结合很差,mRNA则无法有效翻译,从而导致目标蛋白产量低。ARCA(抗反向帽类似物)是第二代帽类似物。因为ARCA在第三位进行了甲氧基的修饰,只有一个3'-OH基团,进行共转录时为定向整合,因此转录过程中只能以正确的方向插入,所形成的mRNA被翻译时的效率相当于mCap形成的mRNA的两倍。
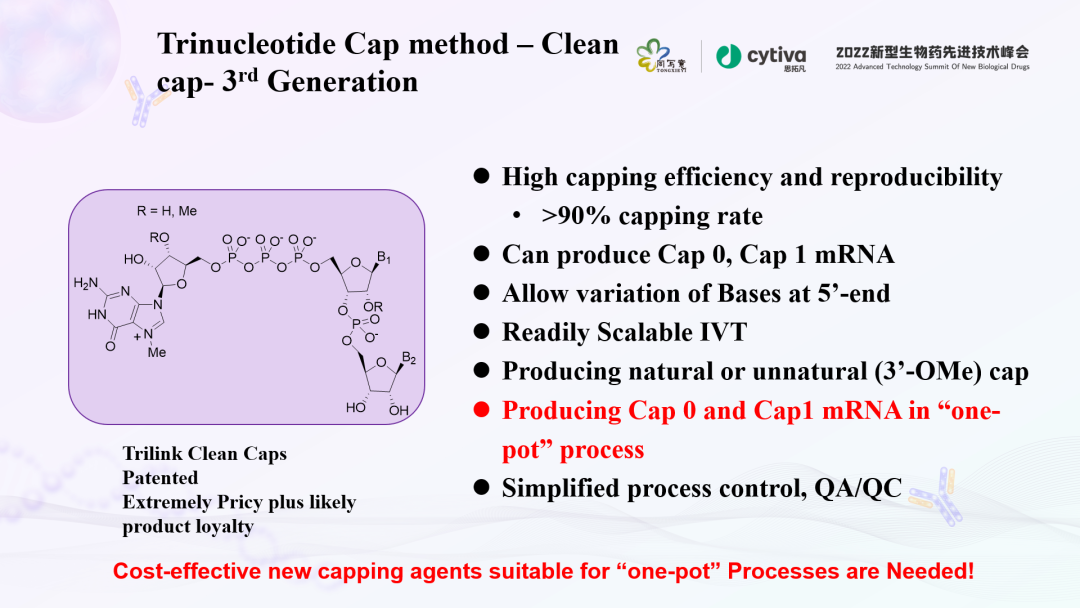
在转录反应中,使用ARCA与GTP的4:1混合物将得到约70%的加帽mRNA。ARCA共转录生成Cap 0结构的mRNA,1μg起始模板量大约转录产生~30μg mRNA产物,转录产量低,并且需要二氧甲基转移酶进一步作用生成Cap1结构的mRNA。第三代Cap1类似物(CleanCap)共转录直接生成Cap1结构的mRNA,1μg起始模板量大约转录产生80-100μg mRNA产量高,加帽效率提高到90%以上。
第三代方法解决了ARCA产量低和加帽效率低的问题。BioNTech上市的新冠疫苗BNT162b2采用共转录加帽工艺。不过,由于这种技术涉及高昂的专利费,业界也亟需能够避开专利实现共转录加帽的新方法。需要考量的因素包括:高效转录过程具有较高的mRNA加帽率;能被eIF4E复合体识别,转录率高;mRNA稳定性好;易于扩大规模和成本效益等。
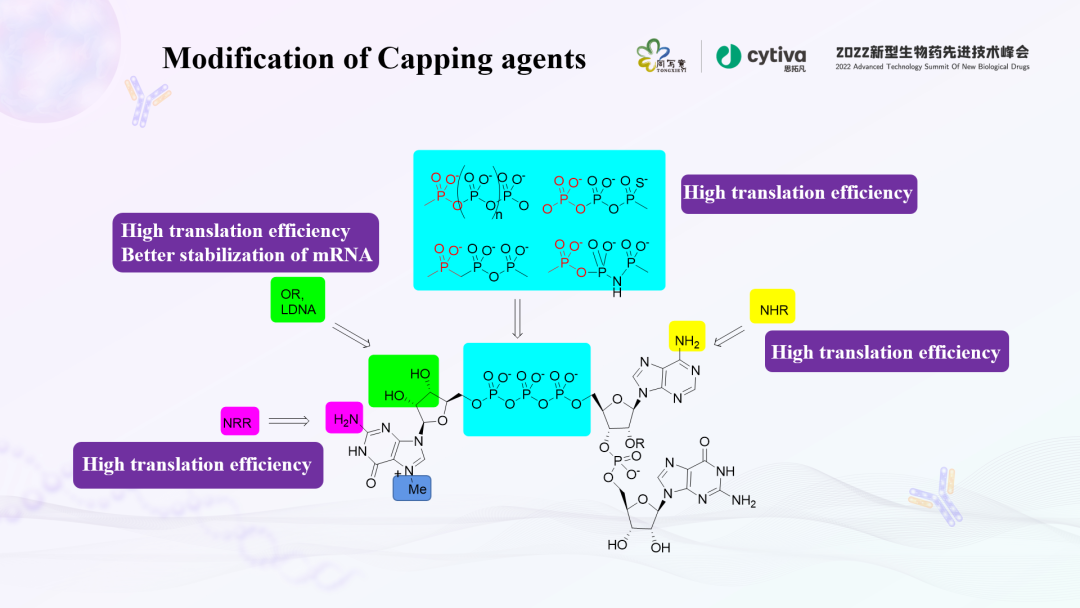
迄今为止,也有很多的研究聚焦在帽结构的化学修饰上,通过在帽结构的不同位置进行不同的修饰改造,可以增加mRNA的表达量。
版权申明:
本文转载于同写意,系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的的媒体或个人可与我们联系,我们将立即进行删除处理。