|
|
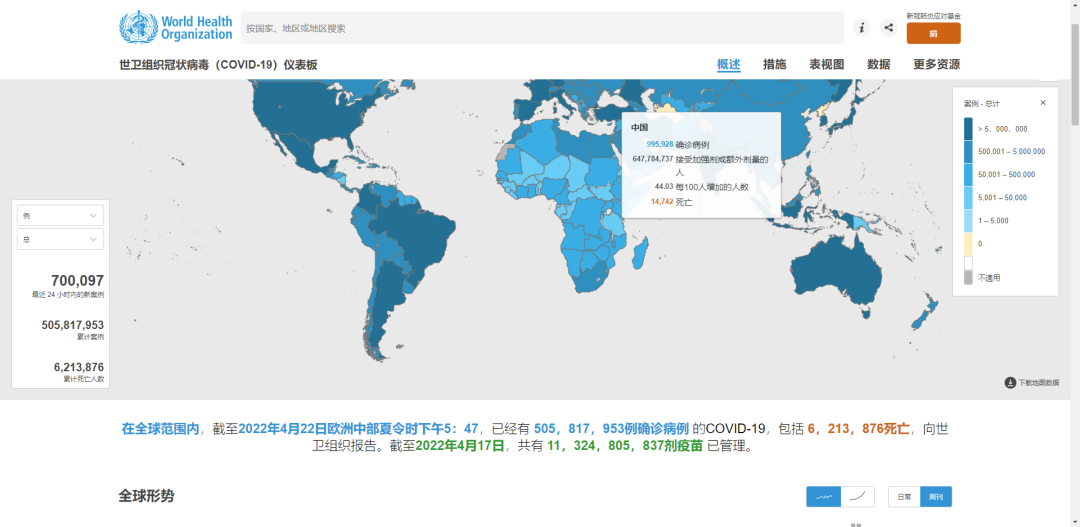
mRNA疫苗何以在对抗新冠中脱颖而出? 新型冠状病毒肺炎(Corona Virus Disease 2019,COVID-19)是一种急性呼吸道传染性疾病,其病原体是严重急性呼吸综合症冠状病毒⁃2(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)。 患者的临床表现包括发热、干咳、呼吸急促、肌肉酸痛、头晕、头痛、喉咙痛、鼻漏、胸痛、腹泻、恶心和呕吐。当病毒载量高或当感染发生在其他严重疾病患者中时,患者经常在短时间内发展为急性呼吸系统综合征和败血症。 世界卫生组织(World Health Organization,WHO)统计数据显示,截至2022年4月17日,全球超过5亿多人已经确诊感染了SARS-CoV-2,导致超600万人的死亡[1]。
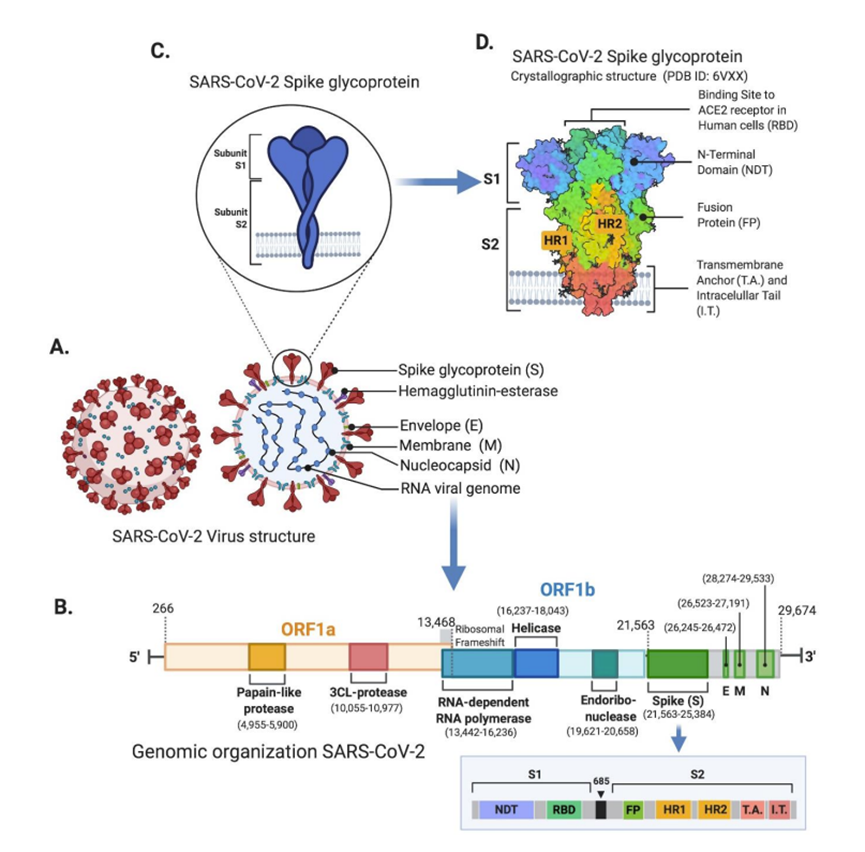
由于COVID-19缺乏特效的抗病毒药物以及有效的治疗措施,疫苗接种是最为有效的防治措施。(https://mp.weixin.qq.com/s/s9FBervCTDYeUYZ8IOmJPw)  SARS-CoV-2属于冠状病毒科β⁃冠状病毒属,有包膜,其基因序列为单股正链的RNA,具有强致病性和高传染性等特点[2]。病毒颗粒呈球形或多形,直径约为60-140nm。具有27-32千碱基(kb)(图1)。
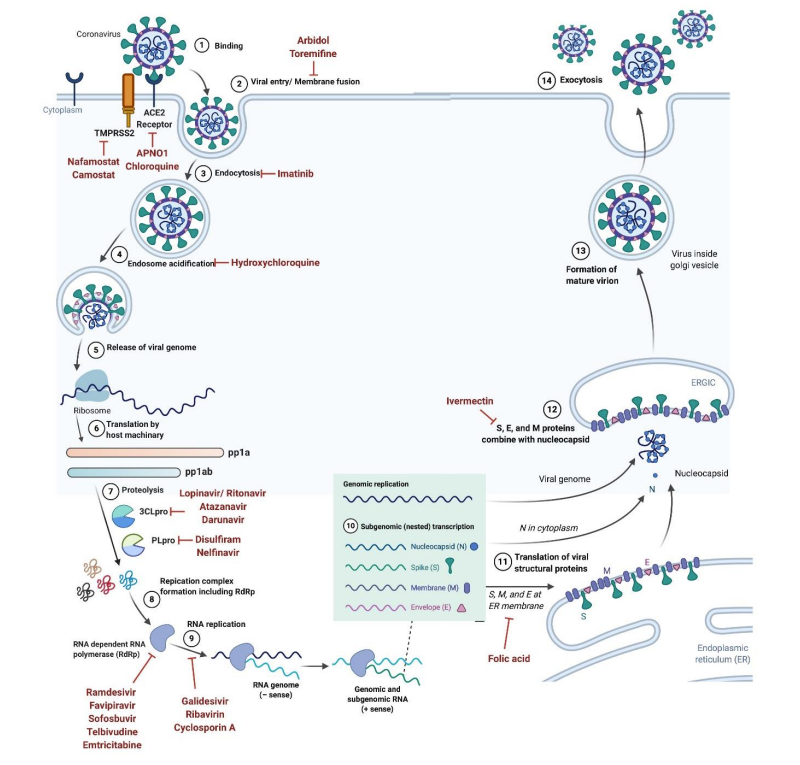
SARS-CoV-2的基因组组织与其他冠状病毒相似,主要由开放阅读框(ORF)组成。 大约67%的基因组通过ORF1a/b编码,它编码16种非结构多蛋白(nsp1-16),而其余33%编码辅助蛋白和结构蛋白。 结构蛋白包括:刺突糖蛋白(spike,S)、包膜蛋白(envelope,E)、膜糖蛋白(membrance glycoprotein,M)和核衣壳蛋白(nucleocapsid,N)。 S糖蛋白由1273个氨基酸组成,包括N端信号肽、S1亚基和S2亚基。S糖蛋白介导SARS-CoV-2与宿主细胞受体血管紧张素转化酶2(Angiotensin-converting enzyme 2,ACE2)的结合,在细胞感染过程中,S蛋白被宿主跨膜丝氨酸蛋白酶2(transmembrane Serine Protease2,TMPRSS2)裂解为S1亚基和S2亚基[4]。 S1包含两个结合域:受体结合域(receptor binding domains,RBD)和N端结构域(N-terminal domain,NTD)。NTD负责与碳水化合物的结合,RBD允许病毒与宿主细胞结合进入宿主细胞[5]。 S2亚基由融合肽(FP)、七肽重复序列1(HR1)、HR2、TM结构域和细胞质结构域组成,对病毒和宿主细胞的膜融合至关重要[6]。 S蛋白是一种主要的保护性抗原,可诱导机体产生高效价的中和抗体(neutralizing antibody,Nab)。此外,S蛋白的S1亚基中的受体结合域(RBD)由中和表位的多个构象结构组成,这些表位是疫苗开发的重要标记,提出含有S蛋白的RBD区域序列或编码RBD序列载体的重组蛋白可作为理想的安全疫苗去预防SARS-CoV-2病毒感染[7]。 因此,S蛋白作为SARS-CoV-2最重要的膜蛋白,RBD与宿主细胞的相互作用作为疫苗设计的一个有吸引力的免疫原性靶点已被广泛研究[8]。 非结构蛋白由3-糜蛋白酶样蛋白酶、木瓜样蛋白酶和RNA依赖的RNA聚合酶以及辅助蛋白等构成[3]。 ORF1a和ORF1b包含一个移码器,产生两个多肽pp1a和pp1ab。 木瓜蛋白酶样蛋白酶(PLpro)或糜蛋白酶样蛋白酶(3CLpro)将这两种多肽加工成16 nsps(图1B)。  从转录和翻译过程开始。新病毒RNA基因组的合成是在RNA依赖性RNA聚合酶的帮助下进行的,该聚合酶利用负支架模板(图2)。 SARS-CoV-2对血管紧张素转换酶2(ACE2)受体的结合亲和力高于其他SARS,从而促进SARS-CoV-2的快速传播。M蛋白是最丰富的结构糖蛋白,负责营养物质在细胞膜上的运输,同时使病毒颗粒形成形。 S或刺突蛋白是构成病毒介蛋白的I型膜糖蛋白。N蛋白有助于结合病毒RNA基因组,同时保持RNA稳定性。E蛋白在发病机制期间的病毒释放和组装中起重要作用(图1和图2)。对SARS-CoV-2全基因组序列的分析表明,它与SARS-CoV的序列相似度为85-95%,表明SARS-CoV-2与SARS-CoV的相容性更高。
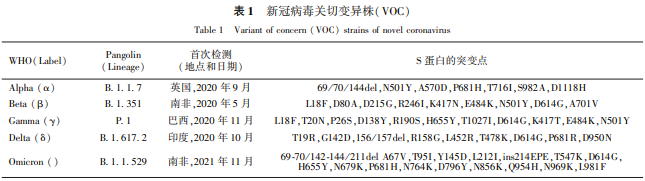
 随着新冠病毒在世界范围内的不断传播,病毒基因组发生突变,形成多种变异株。2020年2月SARS-CoV-2的S蛋白发生D614G型变异是最早被发现的突变基因型,该变异株在感染、复制上具有更高效率,且保持了原始毒株相似的致病力。 此后,SARS-CoV-2的多种变异株被发现,截至2021年11月26日,WHO认定的变异株有5个,分别为B.1.1.7变异株(Alpha)、B.1351变异株(Beta)、P.1变异株(Gamma)、B.1.617.2变异株(Delta)以及B.1.1.529(O-micron)[9]。
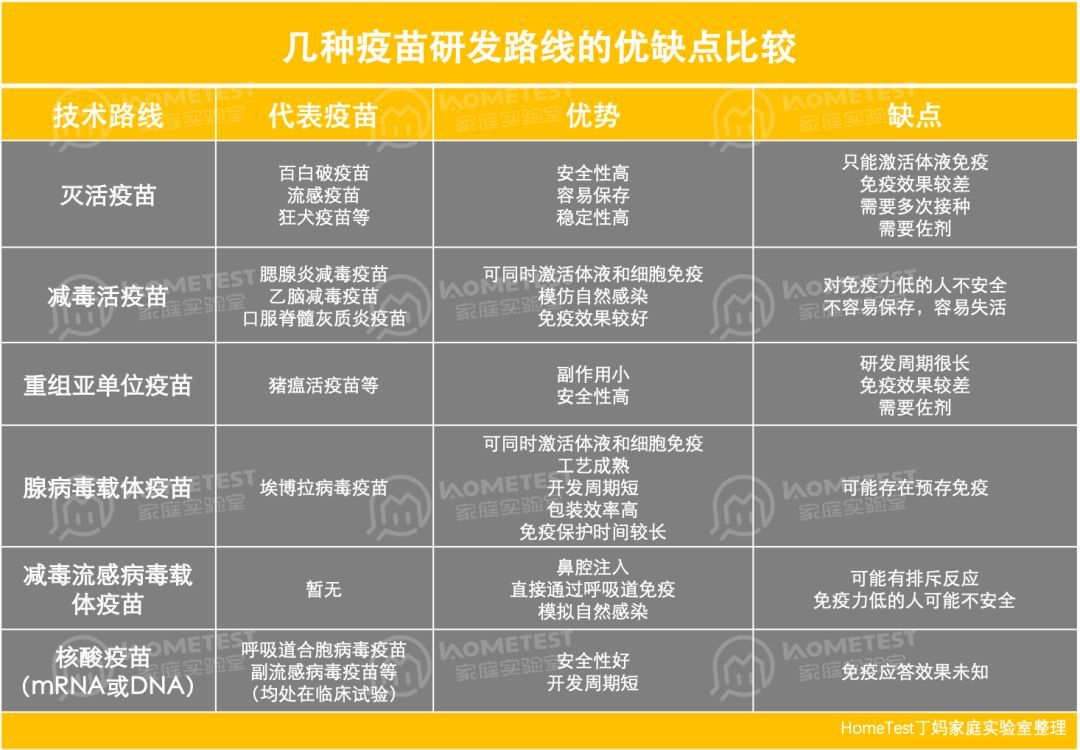
 截至目前,这些变异毒株对COVID⁃19的预防和治疗带来极大挑战。对于控制SARS-CoV-2变异株流行,全人群接种疫苗仍是首要选择,接种第三剂加强针可以有效提高疫苗的保护效果。 现有疫苗主要针对野生型SARS-CoV-2,应加强对新冠病毒新变异株的疫苗研发。目前,SARS-CoV-2的疫苗技术平台基本上都是针对S蛋白的,包括灭活疫苗、减毒活疫苗、重组蛋白疫苗、载体疫苗和核酸疫苗等。 但一些已知的障碍也必须克服才能成功开发疫苗。如抗体依赖的增强作用(Antibody dependent enhancement,ADE)是一种病毒特异性抗体促进病毒通过抗体受体途径进入宿主细胞的现象,导致增强的病毒感染[20]。(DOI: 10.13376/j.cbls/2021037) 灭活疫苗:是将SARS-CoV-2毒株进行培养后,采用理化方法进行灭活后而制成的疫苗。其毒力丧失,但仍具有免疫原性。国药集团北京生物所新型冠状病毒灭活疫苗用新型冠状病毒19nCoV-CDC-Tan-HB02株,在Vero细胞系中进行SARS-CoV-2毒株培养繁殖,经培养、收获病毒液、经两次β⁃丙内酯灭活、浓缩、纯化后,加入氢氧化铝佐剂制成[10]。科兴中维灭活疫苗选用的毒株是新型冠状病毒CZ02株。国药集团武汉生物制品研究所的灭活疫苗毒株为WTV04株灭活疫苗一般需多次免疫病毒抗原处理,在免疫原性灭活过程中可能发生改变,且不能有效诱导黏膜T细胞反应。 灭活疫苗的优势包括研发、生产工艺成熟,在4℃中保存,便于冷链运输,提高了疫苗输送的便捷性。灭活疫苗的局限性,需要分离出野生型毒株进行培养,病毒的培养条件需要进行摸索,例如温度、pH、培养基等,病毒培养需要在P3实验室进行,对实验室安全等级有要求。灭活疫苗的生产需用高热、紫外线、化学制品等手段来处理,监管部门对此种疫苗有严格的监控,不容易被批准。此外,在制备灭活疫苗时如果高浓度的病毒没有被完全灭活,可能会使接种的人感染病毒。 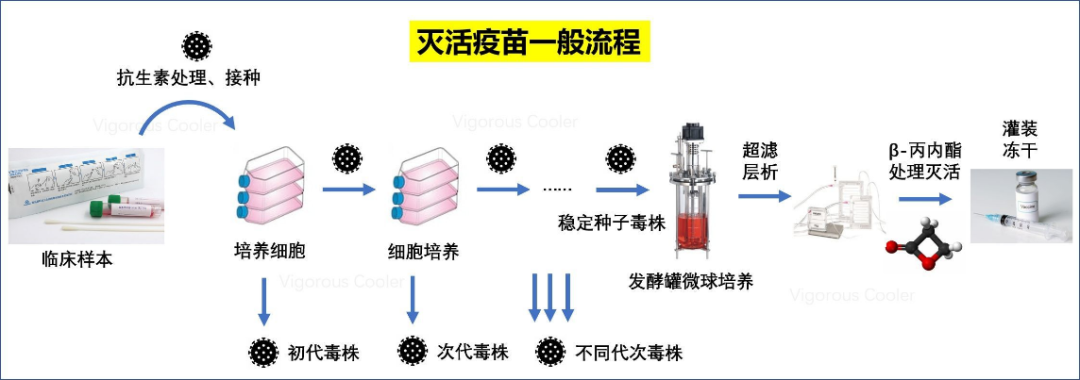   重组蛋白疫苗:是将所需目的基因构建在表达载体上,常用的表达载体有细菌、酵母、哺乳动物或昆虫细胞等,在一定的诱导条件下,表达出具有免疫原性的抗原,将其纯化后制备成疫苗。现有针对新冠病毒的重组疫苗,主要以SARS-CoV-2的S蛋白的RBD区域为靶点进行疫苗的设计[12]。 重组疫苗是目前最为安全的疫苗之一,但由于免疫原性较低,需要与佐剂联用,才具有更好地保护效果。国际上首个获批临床使用的重组蛋白疫苗是ZF2001,由安徽智飞龙科生物与中科院微生物所联合研制[13]。
病毒载体疫苗:是以非致病病毒为载体,将外源保护性抗原基因嵌入载体而形成的疫苗,分为复制型和非复制型两类。常用载体:腺病毒、流感病毒、疱疹病毒、沙门菌等。Ad5-nCoV由军事医学研究院和康希诺共同研发,是我国研发的第一个腺病毒载体新冠疫苗,采用单剂量接种,单针接种28d后,总体保护效力为65.70%[14]。腺病毒载体疫苗单剂次接种能够产生足够免疫力,并且提高了接种者的顺应性。
核酸疫苗:是“第三代疫苗”,是一种新兴的疫苗,分为两种:DNA疫苗和mRNA疫苗。核酸疫苗是在宿主细胞内表达外源抗原,诱导机体产生免疫应答。 由含有哺乳动物表达启动子和编码刺突蛋白抗原的质粒DNA构建,与传统方法相比,DNA疫苗具有可诱导广泛的免疫反应、热稳定性、可在单一疫苗中编码多种抗原、高效的细菌大规模生产和成本效益等优点[15]。DNA疫苗需要进入细胞核产生作用,因此存在整合宿主基因组序列的风险,有一定的安全隐患。DNA为抗原,可能诱导机体产生自身抗体,引发免疫性疾病。外源性DNA同时存在整合到宿主基因组上的潜在风险。
mRNA疫苗包含一个RNA分子,被包裹在脂质纳米颗粒(LNPs)中。肌肉注射后,LNP⁃mRNA在宿主细胞中内化,并作为模板合成全长刺突蛋白抗原。与传统方法相比,mRNA疫苗在安全性、成本效益、诱导细胞和抗体介导的免疫应答方面具有多种优势。mRNA疫苗在细胞内表达目标抗原后,将会被降解,因此mRNA疫苗将插入诱导突变的潜在风险降至最低。mRNA疫苗可以诱导体液免疫和细胞免疫,有良好的保护效果。
Pfizer和BioNTech联合开发的mRNA疫苗BNT162b1/2是一种脂质类纳米颗粒核苷酸修饰疫苗。在抗原免疫方面,BNT162b1/2免疫学反应类似,抗原结合IgG和病毒中和反应,在第2次接种疫苗后明显增强。BNT162b2组相比较于BNT162b1不良反应发生率和强度更低,最终采用BNT162b2进行Ⅱ期和Ⅲ期临床试验[16]。16岁及以上的人接种2剂试验疫苗BNT162b2,间隔21d,显示有95%的保护作用[17]。 
 mRNA疫苗,通过树突状细胞递送和表达编码抗原的mRNA发挥作用,树突状细胞随后呈递抗原并产生中和抗体应答(https://mp.weixin.qq.com/s/povNmIDukYJFirmLrzr15Q)。mRNA疫苗在细胞内表达目标抗原后,将会被降解,因此mRNA疫苗将插入诱导突变的潜在风险降至最低。mRNA疫苗仅通过一次或两次低剂量免疫接种产生强效抗病毒中和免疫球蛋白,诱导体液免疫和细胞免疫,有良好的保护效果。 mRNA疫苗包含一个RNA分子,被包裹在脂质纳米颗粒(LNPs)中。肌肉注射后,LNPs可以有效地帮助mRNA递送到靶细胞中,并保护mRNA免受RNase的侵害(https://mp.weixin.qq.com/s/9BzzecnfLp4qSJSJ4glXSg)(DOI:10.7150/ijbs.59233)。LNP⁃mRNA在宿主细胞中内化,并作为模板合成全长刺突蛋白抗原。与传统方法相比,mRNA的产生有助于大规模生产治疗大规模人群所需的足够剂量的疫苗。在安全性、成本效益、诱导细胞和抗体介导的免疫应答方面具有多种优势。 参考文献: [2] Gaebler, C., Wang, Z., Lorenzi, J., Muecksch, F., Finkin, S., Tokuyama, M., Cho, A., Jankovic, M., Schaefer-Babajew, D., Oliveira, T. Y., Cipolla, M., Viant, C., Barnes, C. O., Bram, Y., Breton, G., Hägglöf, T., Mendoza, P., Hurley, A., Turroja, M., Gordon, K., … Nussenzweig, M. C. (2021). Evolution of antibody immunity to SARS-CoV-2. Nature, 591(7851), 639–644. https://doi.org/10.1038/s41586-021-03207-w [3] Harrison, A. G., Lin, T., & Wang, P. (2020). Mechanisms of SARS-CoV-2 Transmission and Pathogenesis. Trends in immunology, 41(12), 1100–1115. https://doi.org/10.1016/j.it.2020.10.004 [4] Wu, A., Peng, Y., Huang, B., Ding, X., Wang, X., Niu, P., Meng, J., Zhu, Z., Zhang, Z., Wang, J., Sheng, J., Quan, L., Xia, Z., Tan, W., Cheng, G., & Jiang, T. (2020). Genome Composition and Divergence of the Novel Coronavirus (2019-nCoV) Originating in China. Cell host & microbe, 27(3), 325–328. https://doi.org/10.1016/j.chom.2020.02.001 [5] Baldo, V., Reno, C., Cocchio, S., & Fantini, M. P. (2021). SARS-CoV-2/COVID-19 Vaccines: The Promises and the Challenges Ahead. Vaccines, 9(1), 21. https://doi.org/10.3390/vaccines9010021 [6] Walls, A. C., Park, Y. J., Tortorici, M. A., Wall, A., McGuire, A. T., & Veesler, D. (2020). Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein. Cell, 181(2), 281–292.e6. https://doi.org/10.1016/j.cell.2020.02.058 [7] Du, L., He, Y., Zhou, Y., Liu, S., Zheng, B. J., & Jiang, S. (2009). The spike protein of SARS-CoV--a target for vaccine and therapeutic development. Nature reviews. Microbiology, 7(3), 226–236. https://doi.org/10.1038/nrmicro2090 [8] Gupta, D., Sharma, P., Singh, M., Kumar, M., Ethayathulla, A. S., & Kaur, P. (2021). Structural and functional insights into the spike protein mutations of emerging SARS-CoV-2 variants. Cellular and molecular life sciences : CMLS, 78(24), 7967–7989. https://doi.org/10.1007/s00018-021-04008-0 [9] https://www.who.int/en/activities/tracking-SARS-CoV-2-variants/ [10] Xia, S., Zhang, Y., Wang, Y., Wang, H., Yang, Y., Gao, G. F., Tan, W., Wu, G., Xu, M., Lou, Z., Huang, W., Xu, W., Huang, B., Wang, H., Wang, W., Zhang, W., Li, N., Xie, Z., Ding, L., You, W., … Yang, X. (2021). Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. The Lancet. Infectious diseases, 21(1), 39–51. https://doi.org/10.1016/S1473-3099(20)30831-8 [11] Munang'andu H. M. (2018). MucoJet: a novel noninvasive buccal mucosa immunization strategy. Annals of translational medicine, 6(3), 64. https://doi.org/10.21037/atm.2018.01.11 [12] Dai, L., & Gao, G. F. (2021). Viral targets for vaccines against COVID-19. Nature reviews. Immunology, 21(2), 73–82. https://doi.org/10.1038/s41577-020-00480-0 [13] Yang, S., Li, Y., Dai, L., Wang, J., He, P., Li, C., Fang, X., Wang, C., Zhao, X., Huang, E., Wu, C., Zhong, Z., Wang, F., Duan, X., Tian, S., Wu, L., Liu, Y., Luo, Y., Chen, Z., Li, F., … Gao, G. F. (2021). Safety and immunogenicity of a recombinant tandem-repeat dimeric RBD-based protein subunit vaccine (ZF2001) against COVID-19 in adults: two randomised, double-blind, placebo-controlled, phase 1 and 2 trials. The Lancet. Infectious diseases, 21(8), 1107–1119. https://doi.org/10.1016/S1473-3099(21)00127-4 [14] Wu, S., Huang, J., Zhang, Z., Wu, J., Zhang, J., Hu, H., Zhu, T., Zhang, J., Luo, L., Fan, P., Wang, B., Chen, C., Chen, Y., Song, X., Wang, Y., Si, W., Sun, T., Wang, X., Hou, L., & Chen, W. (2021). Safety, tolerability, and immunogenicity of an aerosolised adenovirus type-5 vector-based COVID-19 vaccine (Ad5-nCoV) in adults: preliminary report of an open-label and randomised phase 1 clinical trial. The Lancet. Infectious diseases, 21(12), 1654–1664. https://doi.org/10.1016/S1473-3099(21)00396-0 [15] Silveira, M. M., Oliveira, T. L., Schuch, R. A., McBride, A., Dellagostin, O. A., & Hartwig, D. D. (2017). DNA vaccines against leptospirosis: A literature review. Vaccine, 35(42), 5559–5567. https://doi.org/10.1016/j.vaccine.2017.08.067 [16] Polack, F. P., Thomas, S. J., Kitchin, N., Absalon, J., Gurtman, A., Lockhart, S., Perez, J. L., Pérez Marc, G., Moreira, E. D., Zerbini, C., Bailey, R., Swanson, K. A., Roychoudhury, S., Koury, K., Li, P., Kalina, W. V., Cooper, D., Frenck, R. W., Jr, Hammitt, L. L., Türeci, Ö., … C4591001 Clinical Trial Group (2020). Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. The New England journal of medicine, 383(27), 2603–2615. https://doi.org/10.1056/NEJMoa2034577 [17] Zinatizadeh, M. R., Zarandi, P. K., Zinatizadeh, M., Yousefi, M. H., Amani, J., & Rezaei, N. (2022). Efficacy of mRNA, adenoviral vector, and perfusion protein COVID-19 vaccines. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 146, 112527. https://doi.org/10.1016/j.biopha.2021.112527 [18] Baden, L. R., El Sahly, H. M., Essink, B., Kotloff, K., Frey, S., Novak, R., Diemert, D., Spector, S. A., Rouphael, N., Creech, C. B., McGettigan, J., Khetan, S., Segall, N., Solis, J., Brosz, A., Fierro, C., Schwartz, H., Neuzil, K., Corey, L., Gilbert, P., … COVE Study Group (2021). Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. The New England journal of medicine, 384(5), 403–416. https://doi.org/10.1056/NEJMoa2035389 [19] Teo S. P. (2021). Review of COVID-19 mRNA Vaccines: BNT162b2 and mRNA-1273. Journal of pharmacy practice, 8971900211009650. Advance online publication. https://doi.org/10.1177/08971900211009650 [20] Tirado, S. M., & Yoon, K. J. (2003). Antibody-dependent enhancement of virus infection and disease. Viral immunology, 16(1), 69–86. https://doi.org/10.1089/088282403763635465 [21] Anand, P., & Stahel, V. P. (2021). Review the safety of Covid-19 mRNA vaccines: a review. Patient safety in surgery, 15(1), 20. https://doi.org/10.1186/s13037-021-00291-9 [22] Polack, F. P., Thomas, S. J., Kitchin, N., Absalon, J., Gurtman, A., Lockhart, S., Perez, J. L., Pérez Marc, G., Moreira, E. D., Zerbini, C., Bailey, R., Swanson, K. A., Roychoudhury, S., Koury, K., Li, P., Kalina, W. V., Cooper, D., Frenck, R. W., Jr, Hammitt, L. L., Türeci, Ö., … C4591001 Clinical Trial Group (2020). Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. The New England journal of medicine, 383(27), 2603–2615. https://doi.org/10.1056/NEJMoa2034577 [23] Caminati, M., Guarnieri, G., & Senna, G. (2021). Who Is Really at Risk for Anaphylaxis Due to COVID-19 Vaccine?. Vaccines, 9(1), 38. https://doi.org/10.3390/vaccines9010038 [24] Liu, R., Pan, J., Zhang, C., & Sun, X. (2022). Cardiovascular Complications of COVID-19 Vaccines. Frontiers in cardiovascular medicine, 9, 840929. https://doi.org/10.3389/fcvm.2022.840929 [25] Bozkurt, B., Kamat, I., & Hotez, P. J. (2021). Myocarditis With COVID-19 mRNA Vaccines. Circulation, 144(6), 471–484. https://doi.org/10.1161/CIRCULATIONAHA.121.056135 [26] Plante, J. A., Liu, Y., Liu, J., Xia, H., Johnson, B. A., Lokugamage, K. G., Zhang, X., Muruato, A. E., Zou, J., Fontes-Garfias, C. R., Mirchandani, D., Scharton, D., Bilello, J. P., Ku, Z., An, Z., Kalveram, B., Freiberg, A. N., Menachery, V. D., Xie, X., Plante, K. S., … Shi, P. Y. (2021). Spike mutation D614G alters SARS-CoV-2 fitness. Nature, 592(7852), 116–121. https://doi.org/10.1038/s41586-020-2895-3 版权申明: 本文转载于同写意,系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的的媒体或个人可与我们联系,我们将立即进行删除处理。 |