|
|
IF:34.915〡Biolinkedin® Anti-Flag Magnetic beads&Anti-Flag Affinity gels在选择性自噬分子机制研究中的应用68
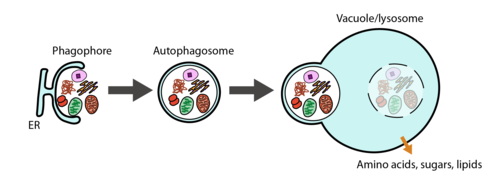
自噬(Autophagy)是真核生物中一种高度保守的分解代谢过程,涉及到细胞器、大分子或入侵的微生物,隔离并转运至溶酶体进行降解。p62/SQSTM1(Sequestosome 1)是第一个被发现的,也是最重要的自噬受体,它具有与泛素(ubiquitin)和LC3相互作用的结构域,能结合泛素化修饰的蛋白,并运输到自噬体。 近日,Military MedicalResearch (IF 34.915)杂志上发表了《TRIM72-mediateddegradation of the short form of p62/ SQSTM1 rheostatically controls selectiveautophagy in human cells》论文,揭示了泛素连接酶TRIM72调控选择性自噬的分子机制。
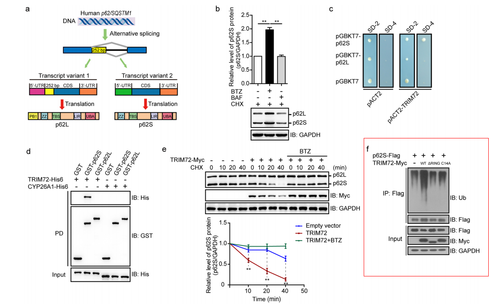
在本研究中,研究者使用了Biolinkedin®Anti-Flag affinity gels 进行免疫沉淀(immunoprecipitation,IP),检测p62S的泛素化修饰 (Fig.1f)。
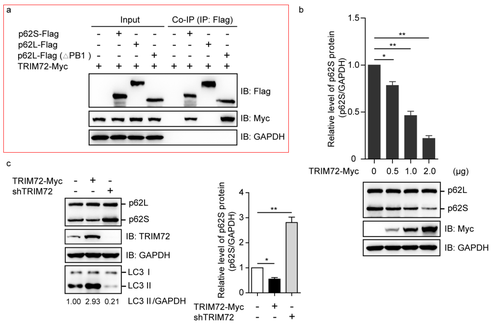
同时,使用了Biolinkedin®Anti-Flag Magnetic beads进行了免疫共沉淀(Co-immunoprecipitation,Co-IP)实验,检测TRIM72与p62S的相互作用(Fig.S3a)
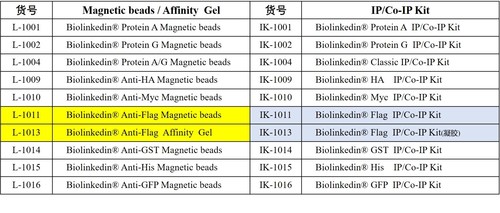
. Biolinkedin免疫沉淀系列产品推荐
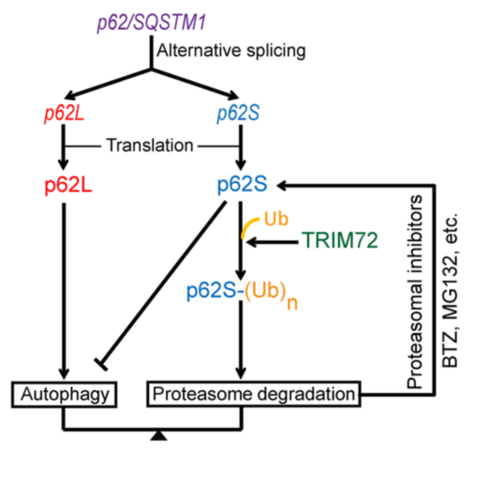
全文解读 人的p62/SQSTM1基因通过可变剪接形成p62L和p6S两个转录本,它们广泛表达于多种人的细胞系。与 p62L蛋白相比,p62S缺失了N端的 1-84 个氨基酸(PB1 结构域内)。 用蛋白酶体抑制剂bortezomib (BTZ)处理细胞时,p62S 和 p62L 蛋白水平均上调,表明它们主要是通过泛素-蛋白酶体途径降解。p62L的蛋白稳态调控已被多篇文章报道,而p62S蛋白的稳态调控之前未见报道。通过酵母双杂交法,筛选到了特异性结合p62S,而与p62L没有相互作用的E3泛素连接酶TRIM72。进一步的实验证实TRIM72可以特异性结合、泛素化修饰并降解p62S。 尽管N端缺少PB1结构域,与p62L一样,p62S也能够高效的结合多泛素链修饰的底物,但却不能介导它们在溶酶体的降解。与p62L不同,p62S会抑制细胞的自噬,使细胞内的氧化蛋白增加,且不利于清除感染的沙门氏菌。当细胞表达较高多的E3泛素连接酶TRIM72时,p62S蛋白水平下降,细胞自噬上升。
总之,该研究揭示了一新的自噬调控机制,涉及到p62/SQSTM1的mRNA剪接、TRIM72介导的泛素化修饰信号与细胞自噬平衡的关系(Fig.1j),可为相关疾病的治疗提供了新的潜在干预靶点。 原文
|