|
|
蛋白纯化篇—金属螯合亲和技术:IDA & NTA,Ni2+ & Co2+1141
一、金属螯合亲和技术 1.1 金属螯合亲和技术概述及其原理[1] 金属螯合亲和技术属于亲和技术的一个分支。1975年Porath首次发现某些蛋白质与某些金属离子(如Cu2+、Fe2+)之间的亲和力可以作为现代色谱技术中蛋白质分离与纯化的基础驱动力(主要包括Zn2+、Cd2+、Hg2+、Co2+、Ni2+等过渡金属离子),并指出固定金属亲和技术是基于蛋白质与金属离子的特异性结合的相互作用过程来实现蛋白的分离纯化。该方法的原理示意图如图1所示,其中的配体分子为与蛋白有相互作用的金属离子。作为金属螯合亲和技术,尤其是配体金属离子,它受到静电作用力、配位键和强共价键的共同作用。金属离子配基属于通用型配基,具有价格低廉、螯合方便、容量大、可在高盐浓度下操作、稳定和容易再生等特点。
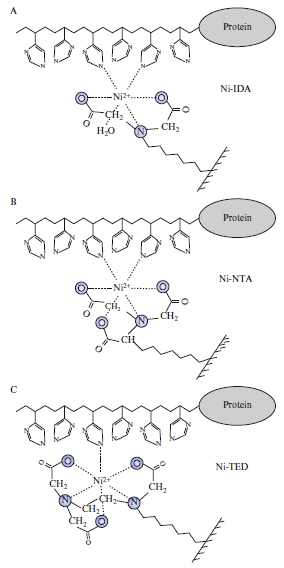
图1 IMAC示意图 金属螯合亲和技术作为一种蛋白质分离纯化的高效方法,它基于各种蛋白质分子的组氨酸、半肌氨酸、色氨酸等残基与许多过渡金属离子发生不同程度的配位结合的特性,在琼脂糖凝胶、琼脂糖磁珠等固相载体上偶联适当的螯合金属离子,制备得到金属螯合亲和树脂,可以选择性结合特定的氨基酸残基的蛋白质。随着生物技术的蓬勃发展,特别是基因工程技术的出现,人们可以按照自己的意愿来设计、改造生物产品,人为地在待分离纯化的蛋白质表面或氨基酸序列末端接上对金属离子有特异性亲和的氨基酸或多肽,来实现蛋白质的分离和纯化。目前,金属螯合亲和技术已成为蛋白质,尤其是基因重组蛋白及多肽分离纯化的最有效工具之一。 1.2 金属螯合亲和技术固定相组成 金属螯合亲和技术中固定相是由基质、间隔臂、螯合剂(络合剂)和金属离子四部分组成。基质为固相载体用以承载金属螯合配体,必须具备以下条件: (1)载体表面具有大量的活性反应基团,如羟基、氨基、羧基,方便间隔臂的连接; (2)载体具有良好的生物相容性,在分离过程中不会引起生物分子的聚沉或失活; (3)载体具有一定的耐酸碱强度,即在较宽的pH范围内使用; (4)载体具备成本低廉易得,易于加工、表面光滑、非特异性吸附小,具有一定的耐压强度。 作为分离蛋白的载体要求粒径小(200μm以内,)、孔径大(30nm以上)、表面积大、分布均匀,常见的有交联琼脂糖(sepharose)、交联葡聚糖(sephadex)、大孔硅胶及一些有机聚合物等。 螯合剂是指将金属离子固定在基质上的物质,既含有与基质共价结合的活性基团如亚氨基、羟基等,又能与金属离子进行配位螯合。为保证固定金属离子可以接受蛋白给予的电子对,螯合剂上配位原子数应小于金属离子的配位数。常用的螯合剂有亚氨基二乙酸(iminodiacetic acid,IDA)、次氨基三乙酸(nitrilotriacetic acid,NTA)、N,N,N-三(羧甲基)乙烯二胺(TED)、四乙烯戊胺(TEPA)、羧甲基α,β-二胺丁二酸(CM-DASA)和乙二胺N,N-二乙酸(EDDA)等[2]。该类试剂的共同点是:(1)分子结构中都含有可提供孤对电子的N、O原子,每个分子的配位原子数至少是3;(2)与金属离子作用时,生成带有多个配位基的金属螯合物,这类螯合物在水介质中与水分子高度溶剂化,具有活泼的羟基和由盐产生的活性基团。其中,IDA适中的亲水性为蛋白质的分离提供了温和的环境,使其在蛋白质分离有着最广泛的应用。但IDA是三配位的,所以与金属离子之间的作用力较弱,容易引起金属离子的遗漏,TED是五配位的,与金属离子作用力较强,但由于仅剩一个键与蛋白质作用,作用力也较弱。NTA与蛋白质的作用介于两者之间。
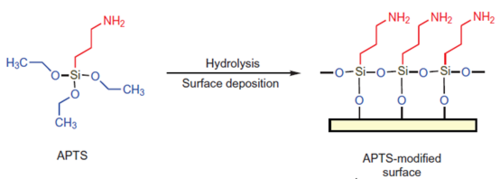
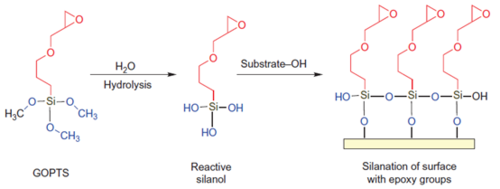
图2 Ni-IDA、Ni-NTA、Ni-TED与His的相互作用 为了将金属螯合配体固定在介质上,偶联前必须使用活化剂将介质活化,形成一段间隔臂,使其末端具有与螯合剂共价结合的活性基团如环氧基团。不同介质的活化剂不同,同一种介质也有很多种活化剂可以使用,需要根据后续需求进行制备。硅胶类介质常用的活化剂主要是硅烷偶联剂,有缩水甘油氧丙基三甲氧基硅烷(GOPTS)、氨丙基三乙氧基硅烷(APTES)等,如图3、4所示。
图3 APTES活化反应示意图
图4 GOPTS活化反应示意图 多元醇聚合物介质,目前常用的活化剂有以下若干种:(1)环氧氯丙烷法,环氧氯丙烷活化较为广泛。环氧氯丙烷法试剂易得,偶联配基牢固且成本较低,缺点是存在着水解反应和交联反应等副反应。(2)二氯亚砜法,该法反应温度较高,反应时间较短,约65℃,5h;缺点是要求体系无水,实际操作不易。(3)双环氧法,采用双环氧化合物,一个与介质羟基连接,一个与螯合剂偶联,典型的反应试剂是1,4-二羟基正丁烷双缩水甘油醚。(4)溴化氰法,此法最早用于亲和树脂的制备,不过剧毒,目前已很少使用。(5)其他方法,如碳二亚胺法、混合酸配法,各种活化方法各有利弊,根据不同的偶联对象和实验目的进行选择。
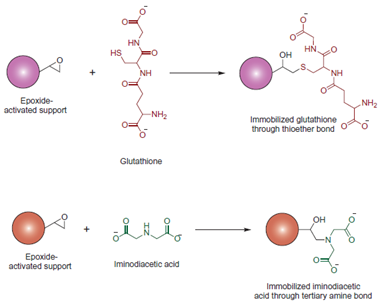
图5 环氧活化基质与IDA、GST偶联 制备金属螯合柱时,通常先用化学方法使活化基质与螯合剂偶联得到具有阳离子交换特性的裸柱,然后灌注选用的金属离子,待吸附饱和,用平衡缓冲液除去过剩的金属离子及制备得到所需柱子。如需更换新的金属离子,可用乙二胺四乙酸(EDTA)去除旧的金属离子,重新结合新的金属离子。可以看出,金属螯合层析技术实质上是把蛋白质与金属离子在液相中的均相反应转移到固液两相进行,经过此步骤,反应的热力学和动力学性质将发生改变,减小了蛋白与金属离子在液相作用的自由度,避免了蛋白变性,使分散在溶液中的蛋白质得到富集和分离。 选择适当的金属离子可以使亲和配基具有良好的重复实用性,又可使亲和配基具有较高的吸附量。在选择金属离子时,需要考虑两点:螯合剂的配位数和金属离子的配位数。螯合剂分子应至少具备两个配位原子,配位数越多,形成的螯合物也越稳定。金属离子的配位数直接影响其与螯合剂及生物分子的结合,配位点既要保证能与螯合剂形成稳定的化合物,又要保证有剩余的位点与目标蛋白结合。当对金属螯合物亲和配基稳定性要求较高时,可选择与金属离子以4∽5个位点配位络合的螯合剂;当对配基的亲和吸附力要求较高时,则可选择配位原子数较少的螯合剂,以便为金属离子留出更多的配位结合位点。常用的金属离子有:Cu2+、Ni2+、Fe2+、Zn2+、Co2+等过渡金属离子,常用的螯合剂有亚氨基二乙酸(IDA)、三羧甲基乙二胺(TED)及次氨基三乙酸(NTA)等,金属离子与螯合剂作用时,一般形成五元环或六元环,结构更稳定,且环数目越多结构越稳定。 二、IDA &NTA,Ni2+ & Co2+ 2.1 IDA & NTA
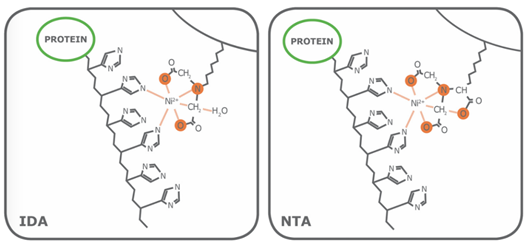
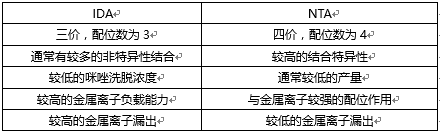
图6 IMAC螯合配体IDA和NTA(IDA是三价而NTA是四价;价态用橙色标出) Porath和同事发明了第一个IMAC琼脂糖树脂,他们将金属离子通过亚氨基二乙酸(IDA)固定到琼脂糖上。现在商品化IMAC琼脂糖仍广泛使用IDA配体,次氮基三乙酸(NTA)在1987年被Hochuli和同事首次引入商品化IMAC中[3]。在那之后,尽管有其他专用螯合配体(例如TED,TALON®)陆续问世,但IDA和NTA始终代表最常用的亲和纯化蛋白IMAC琼脂糖。从结构上看,IDA与NTA的区别在于NTA多了一个羧甲基基团。从化学性质上看,额外的功能基团使得NTA与金属离子的配位能力更强,因为NTA拥有四个效价,而IDA只有三个,如表1所示。 表1 IDA与NTA的比较
当两种配体都有两个价位可以与组氨酸残基的咪唑基相互作用时,配位数对纯化到的蛋白质量有影响。首先,作为一个三价配体(配位数为3),IDA的金属离子漏出率极高,尤其是在平衡和洗脱步骤。尽管NTA琼脂糖的洗脱成分中也含有部分漏出的金属离子,但明显少于IDA树脂。第二,由于目标蛋白性质的变化,用IDA琼脂糖纯化的带组氨酸标签的蛋白通常比用NTA琼脂糖纯化的纯度低。 然而,IDA也有其自身优势,配有IDA配体的琼脂糖通常价格稍低一些。另外,三价配体在洗脱蛋白时需要的咪唑溶液浓度比四价的NTA低。最后,IDA分子更小,可以更高的密度结合到基质上,因此能结合更多的金属离子。通常来说,低装载密度可提高目的蛋白纯化质量降低目的蛋白纯化产量;而高装载密度可提高目的蛋白产量,但会增加非特异性结合。综合考量IDA或NTA的装载密度与不同金属离子的亲和性和特异性(图7),可以提高特定蛋白的纯化产量及质量。
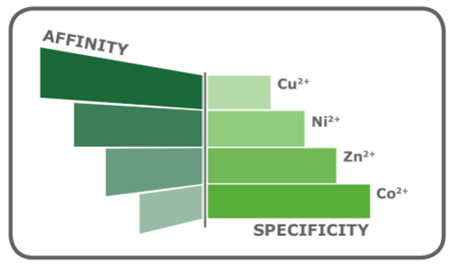
图7 IMAC常用金属离子的相对亲和性和特异性。一方面,铜亲和力高从而纯化蛋白产量高,但是特异性较低。另一方面,钴亲和力较低但特异性高,从而能减少洗脱液中非目的蛋白。 2.2Ni2+ & Co2+ 金属螯合亲和技术是基于蛋白质与固定金属离子的特异性作用进行分离的,根据蛋白质在金属螯合树脂的柱保留特征可以把金属螯合树脂分为两类:一类是与蛋白质强烈结合的树脂,如IDA-Cu树脂;另一类是与蛋白质结合较弱的树脂,如IDA-Ni、IDA-Zn、IDA-Co。我们主要讨论Ni2+和Co2+,根据金属离子所带电荷、离子半径以及电子层结构的不同对蛋白质呈现不同的亲和力。如下: Co2+螯合磁珠蛋白结合量比Ni2+螯合磁珠稍低,但纯度更高; Co2+螯合磁珠洗涤和洗脱所用咪唑浓度都比Ni2+螯合磁珠低。 2.3正确选择 如果你追求高产量,而对蛋白纯度的要求并不高,那么可以选用IDA。它价格较低,性能稳定,易于再生以及再装载金属离子。为减少非特异性结合,可以尝试使用其他金属离子如锌和钴。如果对蛋白纯度要求高的话(例如,为后续结晶做准备),NTA是最佳选择。通过装载特异性高的金属离子(如钴)可进一步提高琼脂糖的特异性。NTA的另一个优点是对如DTT和EDTA之类试剂时有较高的耐受性,因此适用于多种样品缓冲液。琼脂糖种类的选择也很重要,基质和纯化流程会影响最终的结果。另外,纯化蛋白时使用过量的琼脂糖会导致纯度降低,因为很多结合位点没有和目的蛋白结合而暴露。 当纯化少量蛋白时,我们推荐您使用磁珠作为基质;磁珠更适合用于纯化稀释样品中的蛋白、低表达量的蛋白及pull-down实验。如果从中等规模培养物中提取蛋白(>50 μg)最好选用琼脂糖凝胶批量纯化或用重力柱纯化,琼脂糖凝胶也可放大用于大量的蛋白的纯化。 基于此,我司开发了琼脂糖磁珠系列,既利用了磁珠的磁性,便于操作和高通量纯化,又保留了凝胶介质的特性,适合大规模蛋白纯化,一举两得。 2.4样品干扰 被研究样品中的某些化合物的存在会影响IDA-琼脂糖和NTA-琼脂糖的结合能力。DTT(二硫苏糖醇)是一种还原剂,可保护蛋白质的游离巯基不被氧化,破坏SDS-PAGE的样品中的二硫键。DTT可还原IMAC琼脂糖的金属离子,通常会使琼脂糖的颜色变为棕色。 EDTA对于结合能力的影响更为显著。许多缓冲液中有这种六价螯合剂来减少金属离子的干扰。我们的实验显示较高浓度EDTA中Ni-NTA比Ni-IDA更有活力。Ni-NTA的结合能力呈非线性降低,EDTA浓度达到1mM时总体下降了46%,之后略微下调。在EDTA浓度达到1mM前, Ni-IDA的结合能力下降幅度与Ni-NTA相似。然后结合能力剧烈下降。 2.5总结 (1)IDA-琼脂糖介质价格较低; (2)NTA-琼脂糖介质洗脱下来的蛋白通常纯度较高; (3)NTA-琼脂糖介质的金属离子漏出率明显较低; (4)改变金属离子可以改变琼脂糖的结合特异性。Co2+离子特异性最强,其次是Ni2+,Zn2+,最后是Cu2+。 (5)NTA-琼脂糖介质抵抗还原剂和螯合剂的能力强。 三、BiolinkedinÒ相关产品 针对于目前常用的His标签蛋白纯化,我司开发了一系列相应产品,如下表2所示。 表2 BiolinkedinÒ相关产品
BiolinkedinÒ今天就分享到这啦,有兴趣的小伙伴可以申请试用或者联系我们销售。
参考文献: [1]孙永亮. 金属螯合亲和色谱填料的制备及其在六聚组氨酸融合蛋白分离中的应用[D]. 陕西:陕西师范大学,2007. [2]文禹撷.金属螯合亲和配基制备及其在分离豆壳过氧化物酶中的应用[D].2003. [3]Block H , Maertens B , Spriestersbach A , et al. Chapter 27Immobilized-Metal Affinity Chromatography (IMAC)[J]. Methods in Enzymology,2009, 463:439-473. |